Geheimnis der Immunzellaktivierung wurde gelüftet
Das Immunsystem spielt eine essentielle Rolle bei der Abwehr von Mikroorganismen, wie Bakterien, Pilze, Viren und Protozoen. Um seine Aufgaben zu erfüllen, ist das Immunsystem mit speziellen Abwehrzellen ausgerüstet, unter denen die sogenanten T-Zellen eine zentrale Rolle spielen. Ohne T-Lymphozyten ist der Mensch Angriffen durch Mikroben, insbesondere durch Viren und Pilze, schutzlos ausgeliefert.
Die T-Lymphozyten tragen auf ihrer Oberfläche eine Erkennungsstruktur, den so genannten T-Zellrezeptor, der die T-Zellen dazu in die Lage versetzt, eindringende Krankheitserreger, bzw. deren Bruchstücke, zu erkennen und dann eine zielgerichtete Abwehrreaktion einzuleiten. Nach Erkennung von krankmachenden Agenzien durch den T-Zellrezeptor werden die T-Zellen aktiviert und beginnen dann, ihre Aufgaben im Immunsystem zu erfüllen.
Es ist seit langem bekannt, dass unmittelbar nach der Erkennung von Krankheitserregern durch den T-Zellrezeptor im Inneren der T-Zelle Signalkaskaden angeschaltet werden, die die Aktivierungsprozesse steuern. Beim Anschalten dieser Signalkaskaden spielen Phosphorylierungsreaktionen eine wichtige Rolle. So kommt es unmittelbar nach Erkennung von fremden Substanzen durch den T-Zellrezeptor zu einer Phosphorylierung eines zentralen Schalters innerhalb der T-Zelle, der so genannten zeta-Kette. Diese Phosphorylierung ist die „Initialzündung“, die alle nachgeschalteten Signalwege in den T-Zellen steuert. Der Verlust der initialen Phosphorylierung der zeta-Kette führt dazu, dass T-Zellen nicht aktiviert werden können, was sich in einem Ausfall der T-Zell vermittelten Immunantwort widerspiegelt.
Seit mehr als 20 Jahren versuchen Immunologen weltweit herauszufinden, wie die initiale Phosphorylierungsreaktion der zeta-Kette im Inneren der T-Zelle gesteuert wird. Es ist seit langem bekannt, dass hierfür die Tyrosinkinase Lck verantwortlich ist. Trotz intensivster Forschung ist es jedoch bis heute nicht gelungen, zu klären, wie Lck den ersten Schritt der Signalverarbeitung reguliert. Einige Autoren gehen davon aus, dass die Lck-Moleküle immer gleich aktiv sind und in der Zelle einfach hin und hergeschoben werden, und so den Zugang zu der zeta-Kette erhalten. Eine alternative Hypothese besagt, dass Lck nach Erkennung von Krankheitserregern einer Veränderung seiner Struktur unterworfen wird, die in der Folge dazu führt, dass das Molekül aktiviert wird (um dann die Phosphorylierungsreaktion der zeta-Kette einzuleiten).
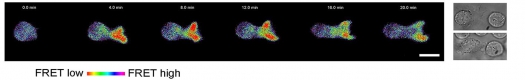
Mittels einer neuen mikroskopischen Technik ist es Magdeburger Immunologen in Zusammenarbeit mit Physikern und Biologen des Leibniz-Institutes für Neurobiologie nun gelungen, ein Verfahren zu entwickeln, mit dem die verschiedenen strukturellen Zustände von Lck in lebenden Zellen detektiert und so nicht-aktive Lck-Moleküle (geschlossene Form) von aktiven Lck-Molekülen (offene Form) „online“ mittels besonderer mikroskopischer Verfahren unterschieden werden können.
Um die verschiedenen Zustände von Lck in T-Zellen zu detektieren, benutzen die Wissenschaftler einen so genannten Lck-Biosensor, der wie folgt funktioniert: Mittels gentechnischer Methoden wurden zwei Fluoreszenzfarbstoffe in das Lck-Molekül eingebaut. Die Farbstoffe wurden so platziert, dass sie sehr nahe zueinander lokalisieren, wenn Lck in der inaktiven, also geschlossenen, Form vorliegt. Dies führt dann dazu, dass zwischen den beiden Farbstoffen Licht- bzw. Energieimpulse ausgetauscht werden, ein Prozess der als FRET (Fluorescence Resonance Energy Transfer) bezeichnet wird. Mittels hochauflösender und sehr sensitiver Mikroskope sowie geeigneter mathematischer Methoden lässt sich das FRET-Signal nicht nur eindeutig nachweisen, sondern es kann in der Zelle lokalisiert werden und seine Größe/Stärke exakt bestimmt werden. Wird Lck aktiviert, so klappt das Molekül auf, was zur Folge hat, dass die beiden Fluoreszenzfarbstoffe weit voneinander entfernt sind, so dass kein Austausch von Energie möglich ist. Dies führt zu einem Verlust des FRET Signals.
Die Magdeburger Immunologen haben nun den Biosensor in T-Zellen eingebracht und dann untersucht, ob sich die Struktur von Lck nach T-Zellaktivierung verändert. In der renommierten Fachzeitschrift Science Signaling zeigen die Autoren, dass etwa 20 Prozent der zellulären Lck-Moleküle nach Erkennung von Krankheitserregern durch den T-Zellrezeptor „aufklappen“. Weiterhin konnten die Autoren zeigen, dass das „Aufklappen“ von Lck tatsächlich mit einer Erhöhung der enzymatischen Aktivität des Enzyms einhergeht und mit der Phosphorylierung der zeta-Kette in der T-Zelle korreliert. Somit konnte durch den Zugang erstmals gezeigt werden, dass Lck im Rahmen der T-Zellaktivierung de novo aktiviert wird.
Mit ihrer Arbeit haben die Immunologen maßgebliche Erkenntnisse in Bezug auf die ersten Schritte der T-Zellaktivierung geliefert. Diese Erkenntnisse sind insofern von Bedeutung, als Pharmafirmen seit vielen Jahren versuchen, Inhibitoren gegen das Lck-Molekül herzustellen, die im klinischen Alltag, z.B. bei der Behandlung von Autoimmunerkrankungen oder auch malignen Erkrankungen eingesetzt werden könnten.
„Wir sind sehr stolz, dass es uns gelungen ist, mittels einer hochsensitiven mikroskopischen Technik, die nur an wenigen Laboratorien weltweit zur Verfügung steht, erstmals zu demonstrieren, dass Lck im Rahmen der T-Zellaktivierung einer deutlichen de novo Aktivierung unterworfen wird“, so der verantwortliche Autor der Veröffentlichung, Prof. Dr. Burkhart Schraven, Direktor des Instituts für Molekulare und klinische Immunologie an der Medizinischen Fakultät der Otto-von-Guericke-Universität Magdeburg (OVGU) und Leiter der Abteilung Immunkontrolle am Helmholtz-Zentrum für Infektionsforschung in Braunschweig. „Mit unserer Arbeit haben wir einen wichtigen Beitrag zu dem seit vielen Jahren währenden wissenschaftlichen Disput um das Lck-Molekül und dessen Biologie geleistet und denken, dass wir eine zentrale Frage der T-Zellimmunologie klären konnten“. Weiter: „Das Besondere an unserer Technik besteht darin, dass mittels ähnlicher Biosensoren nicht nur das Immunsystem untersucht werden kann bzw. Aktivierungsprozesse im Immunsystem, sondern dass es generell möglich ist, die Aktivität ähnlich aufgebauter Moleküle im gesamten Körper zum Beispiel auch im Zentralnervensystem, in der Niere, in der Lunge oder in anderen Organen im Detail zu untersuchen. Wir sind gespannt auf die Resonanz die unser Artikel hervorruft“.
Originalveröffentlichung:
T Cell Activation Results in Conformational Changes in the Src Family Kinase Lck to Induce Its Activation
[DOI: 10.1126/scisignal.2003607]
http://stke.sciencemag.org/cgi/content/abstract/6/263/ra13
Kontakt:
Professor Dr. med. Burkhart Schraven
Institut für Molekulare und Klinische Immunologie
Otto-von-Guericke-Universität Magdeburg
Tel: + 49-(0)391-67-15800
WEB: http://www.med.uni-magdeburg.de/fme/institute/iim/
Zeit- und ortsaufgelöste Visualisierung der Konformationsänderung des Biosensors in lebenden T-Zellen, nachdem der T-Zellrezeptor eine krankmachende Substanz (hier: Protein-A von Staphylococcus aureus) erkannt hat (Größenbalken: 10 Mikrometer)
Aufnahme: Institut





